Conţinut
Alte secțiuniAtomii sunt elementele de bază ale întregii materii. Diferite tipuri de atomi sunt denumiți „elemente” și sunt compilate într-o diagramă numită tabel periodic. Tabelul permite gruparea elementelor similare pe baza proprietăților lor chimice. Interesant este faptul că atomii din același grup au deseori și proprietăți fizice similare. Dacă doriți să înțelegeți proprietățile chimice și fizice ale atomilor, învățați să împărțiți tabelul periodic în grupuri și studiați fiecare proprietățile fiecărui grup.
Pași
Metoda 1 din 3: Împărțirea tabelului periodic
Localizați elementele care nu sunt metale. În tabelul periodic, majoritatea atomilor sunt clasificați ca metale. Alți atomi sunt clasificați ca nemetali. Veți găsi benefice aceste grupări pe măsură ce explorați proprietățile diferiților atomi.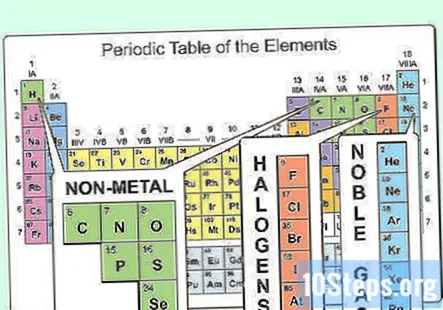
- Nemetalele pot fi găsite în principal în colțul din dreapta sus al tabelului periodic, în timp ce restul tabelului constă în principal din metale. Hidrogenul este o excepție de la această regulă, deoarece acționează ca un nemetal în condiții standard, dar se găsește în colțul din stânga sus al mesei.
- Carbonul, azotul, oxigenul, hidrogenul, sulful și gazele nobile (elementele din coloana din dreapta) sunt nemetale cunoscute în mod obișnuit.
- Halogenii (cum ar fi fluorul, clorul, bromul etc.) se încadrează în categoria nemetalică.

Diferențiați principalele grupări metalice. Metalele sunt grupate în subcategorii. Elementele din aceste subcategorii sunt similare în moduri mai specifice decât doar identificarea ambelor ca metale. Categoriile comune sunt metalele alcaline, metalele alcalino-pământoase, metalele de tranziție, metalele post-tranziție, lantanidele și actinidele.- Metalele alcaline sunt foarte reactive și se ionizează ușor într-o stare.
- Metalele alcalino-pământoase sunt puțin mai puțin reactive, dar se ionizează ușor la o stare 2.
- Metalele de tranziție și post tranziție sunt mai stabile și au multe stări de ionizare diferite.
- Lantanidele și actinidele sunt molecule mai mari, mai puțin stabile, care reacționează ușor. Unele dintre ele se descompun, făcându-le radioactive.

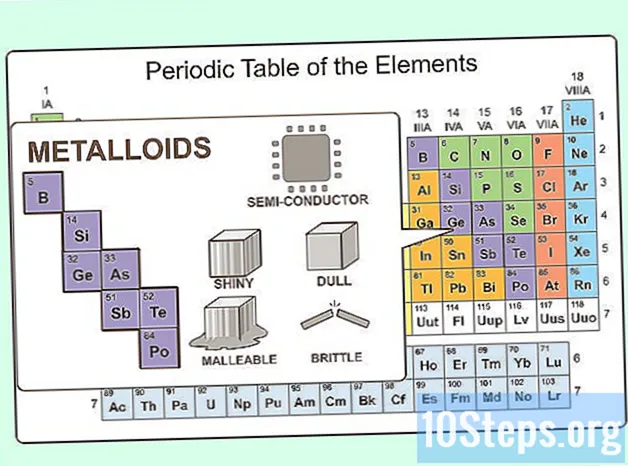
Imaginați-vă ceva între un metal și nemetal. Astfel de elemente există și sunt cunoscute sub numele de metaloizi. Pe tabelul periodic, metaloizii apar între metalele post-tranziție și nemetalele. Există opt metaloizi:- Bor
- Siliciu
- Germaniu
- Arsenic
- Antimoniu
- Telurul
- Poloniu
- Astatine
Metoda 2 din 3: Analiza caracteristicilor chimice

Uită-te la ordinea mesei. Când vă uitați la tabelul periodic, veți observa că elementele sunt toate numerotate. Această numerotare este departe de a fi întâmplătoare. De fapt, este cunoscut ca numărul atomic pentru acel element particular și este egal cu numărul de protoni pe care elementul îi are în nucleul său.- Pentru atomi (nu ioni), numărul atomic reprezintă, de asemenea, numărul de electroni din atom. Numărul de protoni și electroni dintr-un atom este egal.
- Pe unele tabele periodice, veți observa un al doilea număr care este într-un font mai mic. Aceasta este masa atomică medie pentru acel element.
Vizualizați electronii de valență. Electronii de valență sunt electronii din învelișul exterior al norului de electroni al unui atom. Electronii de valență sunt cel mai mare factor în modul în care atomul va reacționa chimic. Cea mai stabilă configurație pentru un atom este aceea de a avea umplut electronii din învelișul său exterior, prin urmare nu se va lega cu alți atomi. În majoritatea cazurilor, carcasa exterioară trebuie să conțină opt electroni pentru a fi plină (în funcție de mărimea atomului, aceasta poate varia).
- De exemplu, fluorul are nouă electroni. Primii doi umple cel mai interior orbital, restul de șapte sunt electroni de valență. Aceasta înseamnă că fluorul are nevoie de încă un singur electron pentru a-și umple carcasa de valență. Astfel, fluorul reacționează ușor cu atomii care pot renunța la un electron (în special metalele).
- Un exemplu al opusului este litiul. Litiul are trei electroni. Primele două umple învelișul cel mai interior și ultima este un electron de valență. Deoarece litiul ar trebui să câștige șapte electroni pentru a-și umple carcasa de valență, este mai ușor (mai favorabil din punct de vedere energetic) ca acesta să arunce singurul electron de valență pe care îl are. Deci, litiul reacționează ușor cu elemente care vor accepta un electron (cum ar fi halogenii).
Luați în considerare dimensiunea atomului. Deși electronii de valență sunt cel mai bun predictor al proprietăților chimice într-un atom dat, contează și dimensiunea atomului. Atomii mai mari au mai mulți electroni între nucleu și electronii de valență, ceea ce înseamnă că aceștia sunt ținuți la atom mai slab decât la atomii mai mici. Aceasta explică de ce doi atomi cu același număr de electroni de valență (de exemplu, fluor și clor) au proprietăți chimice similare, dar nu identice.
Aflați tendințele tabelului periodic. Cunoașterea tendințelor periodice vă poate ajuta să recunoașteți proprietățile chimice probabile ale unui element pe baza locației sale în tabelul periodic. Cu toate acestea, este important să ne amintim că trei grupuri (gaze nobile, lantanide și actinide) nu urmează aceste tendințe datorită chimiei lor unice. Unele tendințe periodice sunt:
- Masa atomică crește de la stânga la dreapta și de sus în jos.
- Raza atomică scade de la stânga la dreapta și crește de sus în jos.
- Electronegativitatea crește de la stânga la dreapta și scade de sus în jos.
- Energia de ionizare crește de la stânga la dreapta și scade de sus în jos.
- Afinitatea electronică crește de la stânga la dreapta și scade de sus în jos.
- Caracterul metalic scade de la stânga la dreapta și crește de sus în jos.
Metoda 3 din 3: Examinarea atributelor fizice
Identificați proprietățile nemetalice. Nemetalele există în trei stări fizice la temperatura camerei (solid, lichid și gaz), dar sunt în principal gaze la temperatura camerei. Nemetalele sunt de obicei plictisitoare și fragile atunci când sunt solide și, de obicei, se topesc și fierb la temperaturi mai scăzute decât metalele. Nemetalele sunt, de asemenea, conductori slabi ai căldurii și electricității.
- Singurul nemetal care este un lichid la temperatura camerei este bromul.
- Carbonul are cel mai înalt punct de topire dintre toate elementele.
Cunoașteți proprietățile fizice ale metalelor. Metalele sunt strălucitoare și maleabile. De asemenea, conduc bine căldura și electricitatea. Metalele sunt în mare parte solide la temperatura camerei, deși mercurul este un lichid. Metalele au, în general, puncte de topire și fierbere ridicate în comparație cu nemetalele.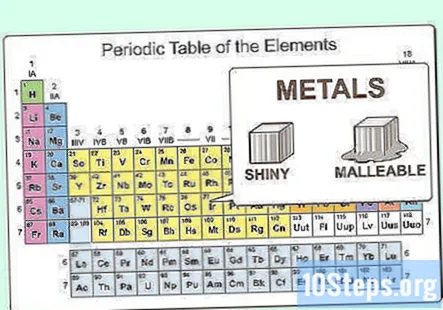
Observați gazele nobile. Elementele care alcătuiesc coloana din dreapta sunt cunoscute sub numele de gaze nobile. Sunt inerte chimic și se găsesc toate în faza gazoasă la temperatura camerei. Aceste gaze sunt utilizate pentru lucruri precum umplerea baloanelor și a semnelor de iluminat.
Luați în considerare metaloizii. La fel ca metaloizii posedă proprietăți chimice atât ale metalelor, cât și ale nemetalelor, posedă proprietăți fizice ale ambelor. Sunt semiconductori. Pot fi maleabile sau fragile. Ele pot fi, de asemenea, strălucitoare sau plictisitoare.
Întrebări și răspunsuri comunitare
Nu se presupune că electronegativitatea crește un grup?

Cercetătorul științific Meredith Juncker este doctorand în biochimie și biologie moleculară la Louisiana State University Health Science Center. Studiile sale se concentrează pe proteine și boli neurodegenerative.

sfaturi
- Puteți crea note pentru a studia diferite grupuri de elemente.
- Dacă aveți voie să utilizați un tabel periodic pentru examene și teste, îl puteți folosi pentru a vă ajuta să găsiți multe dintre răspunsuri.
Avertizări
- Există o mulțime de informații conținute în tabelul periodic. Luați-vă timp și studiați în fiecare zi, în loc să încercați să-l păstrați într-o singură sesiune de cram.


